英文名:resmetirom
研发公司:Madrigal Pharmaceuticals
适用症:非肝硬化非酒精性脂肪性肝炎(NASH)
型号规格:100mg
Rezdiffra是一款甲状腺激素受体(THR)-β口服选择性激动剂。THR-β在人体肝脏中高表达,能够调节脂代谢,降低LDL-C、甘油三酯和致动脉粥样硬化性脂蛋白。THR-β还可以通过促进脂肪酸的分解和刺激线粒体的生物发生来减少脂肪毒性、改善肝功能,进而减少肝脏脂肪。因此,THR-β激动剂具备调控多种肝脏代谢通路来治疗NASH的潜力。
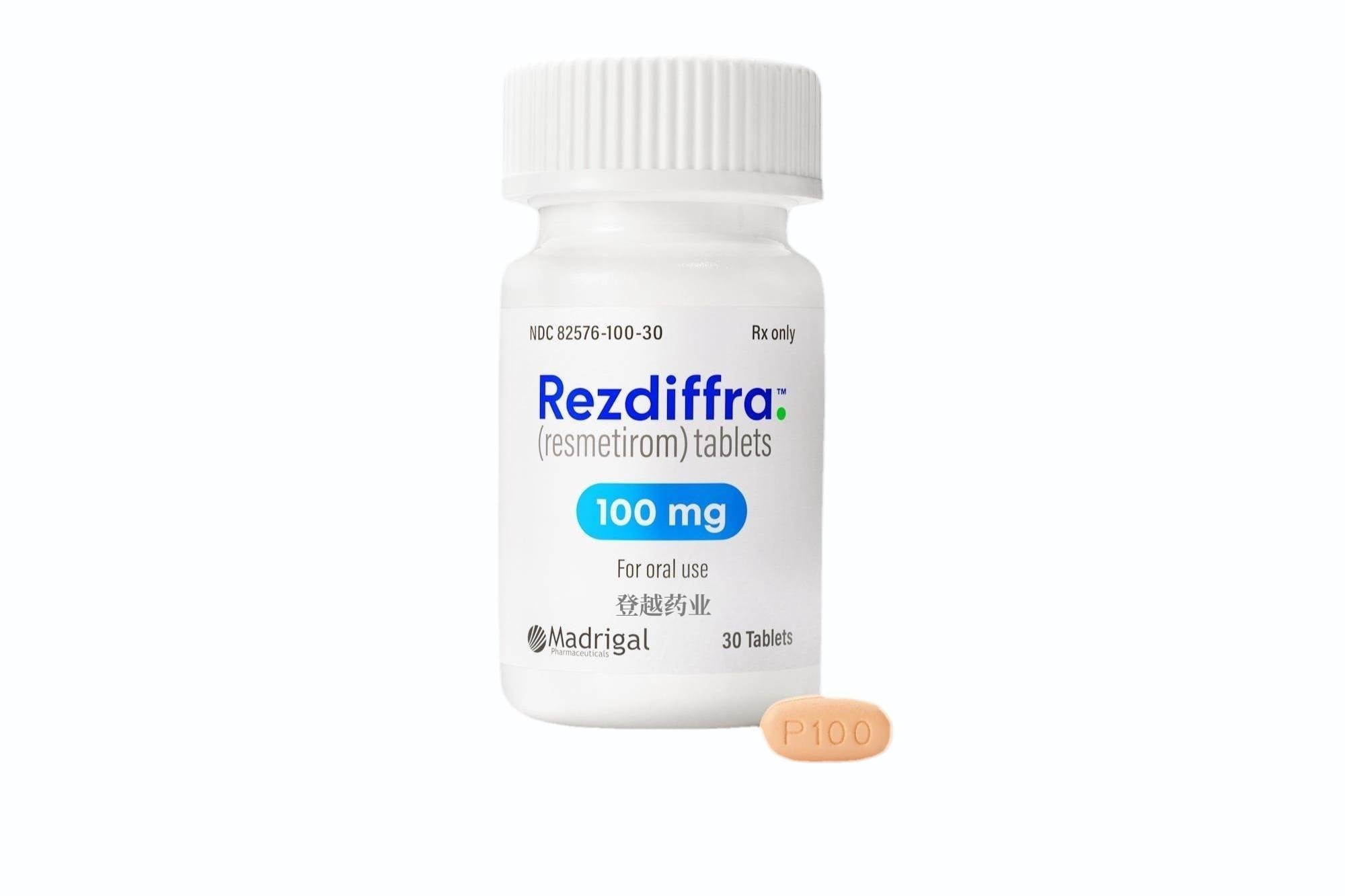
【规格】
•60mg:白色椭圆形薄膜包衣片,一面刻有“P60”字样,另一面为平片。
•80mg:黄色椭圆形薄膜包衣片剂,一面刻有“P80”字样,另一面为平片 。
•100mg:米色至粉红色,椭圆形,薄膜包衣片剂,一面刻有“P100”字样,另一面为平片。
【适应症】
REZDIFFRA与饮食和运动相结合,用于治疗成人非肝硬化非酒精性脂肪性肝炎(NASH)伴中晚期肝纤维化(与F2至F3期纤维化一致)。该适应症是在基于NASH和纤维化改善的加速批准下获批的。该适应症的持续批准可能取决于验证性试验中对临床益处的验证和描述。
使用限制:失代偿期肝硬化患者应避免使用REZDIFFRA。
【贮藏】
储存温度为20°C至25°C(68°F至77°F);允许偏差至15°C至30°C(59°F至86°F)。
【剂量与用法】
1、推荐剂量与用法
REZDIFFRA的推荐剂量调整基于实际体重。对于体重:• <100kg的患者,建议剂量为80mg,每日口服一次。• ≥100kg,推荐剂量为100mg,每日口服一次。
可随餐或单独服用REZDIFFRA。
2、CYP2C8抑制剂的剂量调整
不建议同时使用REZDIFFRA和强效CYP2C8抑制剂(如吉非罗齐)。
如果REZDIFFRA与中度CYP2C8抑制剂(如氯吡格雷)同时使用,则减少REZDIFFRA的剂量:
• <100kg,将REZDIFFRA的剂量减少至60mg,每天一次。
• ≥100kg,将REZDIFFRA的剂量减少至80mg,每日一次。
【警告和注意事项】
1、肝脏毒性
使用REZDIFFRA已观察到肝毒性。一名患者在基线时丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转换酶(AST)和总胆红素(TB)水平正常,每天接受80 mg REZDIFFRA治疗,肝脏生物化学显著升高,治疗中断后症状消失。再次服用REZDIFFRA后,患者ALT、AST和TB升高。观察到的峰值为ALT的58倍正常上限(ULN)、AST的66倍ULN、TB的15倍ULN,没有碱性磷酸酶(ALP)升高。肝酶的升高伴随着免疫球蛋白G水平的升高,提示药物诱导的自身免疫性肝炎(DI-ALH)。在没有任何治疗干预的情况下住院并停用REZDIFFRA后,肝脏测试恢复到基线。
在REZDIFFRA治疗期间监测患者的肝脏测试升高和肝脏相关不良反应的发展。监测肝毒性的症状和体征(如疲劳、恶心、呕吐、右上腹疼痛或压痛、黄疸、发烧、皮疹和/或嗜酸性粒细胞增多症[>5%])。如果怀疑有肝毒性,停用REZDIFFRA并继续监测患者。如果实验室值恢复到基线,则权衡重新启动REZDIFFRA的潜在风险和益处。如果实验室值没有回到基线,在评估肝脏测试中的升高时,考虑DI-ALH或自身免疫性肝病。
2、胆囊相关不良反应
在临床试验中,与安慰剂治疗的患者相比,REZDIFFRA治疗的患者更容易观察到胆结石、急性胆囊炎和梗阻性胰腺炎(胆结石)。如果怀疑有胆结石,需要进行胆囊诊断研究和适当的临床随访。如果怀疑急性胆囊事件,中断REZDIFFRA治疗,直到事件得到解决。
3、与某些他汀类药物的相互作用
当与REZDIFFRA同时给药时,观察到阿托伐他汀、普伐他汀、瑞舒伐他汀和辛伐他汀的暴露量增加,这可能会增加与这些药物相关的不良反应的风险。建议对某些他汀类药物进行剂量调整。监测他汀类药物相关的不良反应,包括但不限于肝脏检查升高、肌病和横纹肌溶解症。
【不良反应】
以下具有临床意义的不良反应在标签的其他地方进行了描述:肝毒性、胆囊相关不良反应。
【特殊人群用药】
1、妊娠期
风险概述
目前尚无关于REZDIFFRA在孕妇中用于评估药物与主要出生缺陷、流产或其他不良母体或胎儿结局相关风险的可用数据。潜在NASH合并肝纤维化可能对母亲和胎儿造成风险。在动物生殖研究中,在器官发生过程中,妊娠兔使用resmetirom 3.5倍的最大推荐剂量,会对胚胎-胎儿发育产生不利影响。这些影响与母体毒性有关,而在妊娠兔中,较低剂量水平的耐受性较好,未观察到胚胎-胎儿效应。Resmetirom及其代谢物MGL-3623未对妊娠大鼠的胚胎发育产生影响。一项对器官发生至哺乳期母体给予resmetirom的大鼠进行的产前和产后发育研究显示,在最大推荐剂量的37倍下,出生体重减少,死产和死亡率增加(出生后1-4天)。这些影响与母体T4、T3和TSH水平的显著抑制有关。
指定人群发生重大出生缺陷和流产的背景风险尚不清楚。所有妊娠都有出生缺陷、流产和其他不良后果的背景风险。在美国普通人群中,临床公认的妊娠中发生重大出生缺陷和流产的背景风险估计分别为2%至4%和15%至20%。
2、哺乳期
风险概述
没有关于母乳中REZDIFFRA的存在、对母乳喂养婴儿的影响以及对乳汁生产的影响的信息。母乳喂养对发育和健康的益处应与母亲对REZDIFFRA的临床需求以及REZDIFFRA或潜在母体疾病对母乳喂养婴儿的任何潜在不利影响一起考虑。
3、儿科使用
REZDIFFRA在儿科患者中的安全性和有效性尚未确定。
4、老年使用
在试验1中,在至少接受一剂REZDIFFRA的594名NASH患者中,149人(25%)年龄在65岁及以上,13人(2%)年龄在75岁及以上。与年轻成年患者相比,65岁及以上患者的疗效没有总体差异,但不良反应发生更高。
5、肾损伤患者
轻度或中度肾功能损害患者的推荐剂量与肾功能正常患者相同。REZDIFFRA尚未在严重肾功能损害患者中进行研究。
6、肝损伤患者
对于失代偿期肝硬化(与中度至重度肝损伤一致)患者,应避免使用REZDIFFRA。中度或重度肝损伤(Child-Pugh B级或C级)会增加Cmax和AUC的出现率,这可能会增加不良反应的风险。
轻度肝损伤(Child-Pugh A级)患者不建议调整剂量。
REZDIFFRA在NASH肝硬化患者中的安全性和有效性尚未确定。
温馨提示:以上资讯由登越药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药业)





