药品别名:sotagliflozin
英文名:sotagliflozin
研发公司:Lexicon Pharmaceuticals,Inc.
适用症:心力衰竭或2型糖尿病、慢性肾病
型号规格:200mg 400mg
【适应症】
INPEFA(索格列净)适用于降低以下成人的心血管死亡、因心力衰竭住院和紧急心力衰竭访视风险:
1、心力衰竭或
2、2型糖尿病、慢性肾病和其他心血管风险因素
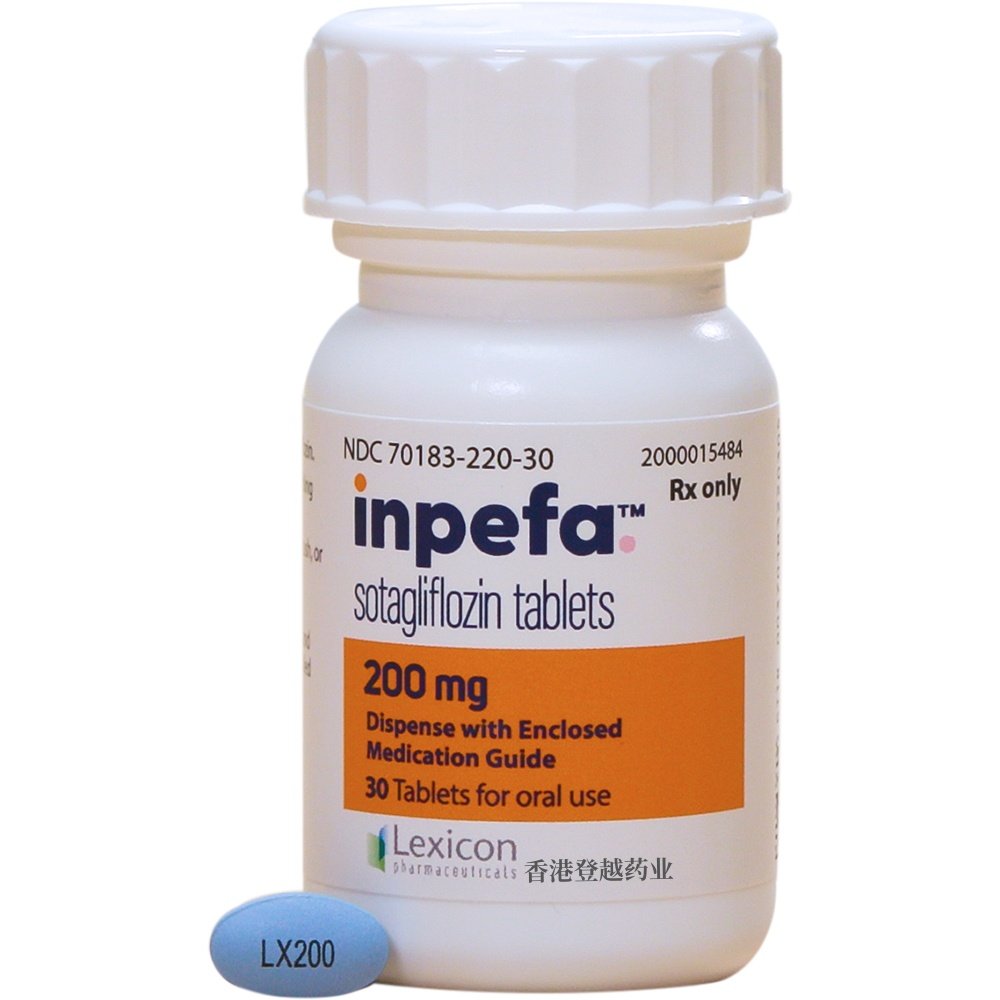
【剂型和规格】
INPEFA 200 mg 片剂为椭圆形、蓝色、薄膜包衣片,用黑色油墨印有“LX200”字样。
INPEFA 400 mg 片剂为椭圆形、黄色、薄膜衣片,一面凹刻“2457”。
【用法用量】
1、开始INPEFA(索格列净)治疗前
开始INPEFA(索格列净)治疗前,评估容量状态,如有必要,评估血容量是否耗竭。
开始INPEFA(索格列净)治疗前以及有临床指征时评估肾功能 。
对于失代偿性心力衰竭患者,可在患者血流动力学稳定后尽快开始给药,包括住院或紧急门诊治疗期间或出院后立即给药。
2、推荐剂量
1)INPEFA(索格列净)的推荐起始剂量为 200 mg 口服给药,每日一次,每日首次进餐前不超过1小时。
2)至少2周后,根据耐受情况将剂量上调至 400 mg 口服每日一次。必要时可将剂量下调至 200 mg。
3)整片吞服。请勿切割、压碎或咀嚼片剂。
4)如果 INPEFA 漏服时间超过6小时,则在第二天按照处方服用下一剂。
3、手术暂时中断
如果可能,在进行大手术或与长期禁食相关的程序之前,暂停INPEFA(索格列净)至少3天。当患者临床稳定并恢复经口摄入时,重新开始INPEFA(索格列净)治疗。
【不良反应】
常见不良反应:
尿路感染、血容量不足、腹泻、低血糖、头晕、生殖器真菌感染
【注意事项】
1、1型糖尿病和其他酮症酸中毒患者的糖尿病酮症酸中毒
在1型糖尿病患者中,INPEFA(索格列净)显著增加了糖尿病酮症酸中毒(一种危及生命的事件)的风险,超过了背景发生率。在1型糖尿病患者的安慰剂对照试验中,与接受安慰剂的患者相比,接受钠葡萄糖协同转运蛋白 2(SGLT2) 抑制剂的患者发生酮症酸中毒的风险显著增加;INPEFA(索格列净)剂量越高,该风险可能越大。INPEFA不适用于血糖控制。
2、容量不足
INPEFA(索格列净)可引起血管内容量耗竭,有时可能表现为症状性低血压或肌酐的急性一过性变化。
在具有一个或多个这些特征的患者开始INPEFA(索格列净)治疗前,评估容量状态和肾功能。开始治疗后,监测低血压的体征和症状,以及肾功能。
3、尿脓毒症和肾盂肾炎
SGLT2 抑制剂(包括INPEFA)治疗会增加尿路感染的风险。已报告需要住院的严重尿路感染,包括尿脓毒症和肾盂肾炎。评价患者的尿路感染体征和症状,如有指征,及时治疗。
4、与胰岛素和胰岛素促泌剂合并使用的低血糖
已知胰岛素和胰岛素促泌剂可引起低血糖。INPEFA(索格列净)与胰岛素或胰岛素促泌剂联合使用时可能会增加低血糖风险 [见不良反应]。因此,当这些药物与INPEFA(索格列净)联合使用时,可能需要较低剂量的胰岛素或胰岛素促泌剂,以将低血糖风险降至最低。
5、会阴坏死性筋膜炎(阴囊福尼尔坏疽)
应评估接受INPEFA(索格列净)治疗的生殖器或会阴区域出现疼痛、压痛、红斑或肿胀,以及发热或不适的患者的坏死性筋膜炎。如果怀疑,立即开始广谱抗生素治疗,必要时进行手术清创。停用INPEFA,密切监测血糖水平,并为心力衰竭提供适当的替代疗法。
6、生殖器真菌感染
INPEFA(索格列净)可增加生殖器真菌感染的风险。有生殖器真菌感染史的患者更有可能发生生殖器真菌感染 [参见不良反应]。适当监测和治疗。
7、尿糖试验阳性
不建议通过尿糖试验监测葡萄糖水平,因为 SGLT2 抑制会增加尿糖排泄,并将导致尿糖试验阳性。使用替代方法监测血糖水平。
8、对1,5-脱水葡萄糖醇 (1,5-AG) 测定的干扰
不建议使用1,5-AG试验监测血糖水平,因为在评估服用 SGLT2 抑制剂的患者的血糖水平时,1,5-AG测量不可靠。使用替代方法监测血糖水平。
【特殊人群用药】
1、怀孕
基于显示肾脏影响的动物数据,不建议在妊娠中期和妊娠晚期使用INPEFA(索格列净)。
2、哺乳期
尚无关于人乳汁中存在INPEFA(索格列净)、对母乳喂养婴儿的影响或对乳汁生成影响的数据。
3、儿童用药
尚未确定INPEFA(索格列净)在18岁以下儿童患者中的安全性和有效性。
4、老年人用药
不建议根据年龄改变INPEFA(索格列净)剂量。老年患者发生血容量不足不良反应(包括低血压)的风险可能增加。在≥65岁的患者中,INPEFA(索格列净)治疗组发生血容量不足不良反应的患者比例更高 [参见警告和注意事项和不良反应]。
5、肾损害
INPEFA(索格列净)的疗效和安全性研究未入组慢性肾病患者(eGFR 25~60 mL/min/1.73 m 2)或接受透析的患者。在这些研究中开始治疗后,如果 eGFR 低于15 mL/min/1.73 m 2或开始长期透析,则患者停药。
6、肝损害
在肝损伤患者的临床药理学研究中,轻度肝损伤受试者的暴露量未增加,但中度和重度肝损伤受试者的暴露量分别约为肝功能正常受试者的3倍和6倍。
轻度肝损害患者无需调整剂量。
尚未确定INPEFA(索格列净)在中度或重度肝损害患者中的安全性和疗效。不建议将INPEFA(索格列净)用于中度或重度肝损害患者。
【禁忌症】
INPEFA(索格列净)禁用于对INPEFA(索格列净)有严重超敏反应史的患者。
药物相互作用
1、地高辛
与INPEFA(索格列净)400 mg 联合给药时,地高辛的暴露量增加。应适当监测同时使用 INPEFA 和地高辛的患者。
2、尿苷二磷酸葡萄糖醛酸转移酶 (UGT) 诱导剂
经 UGT1A9 葡萄糖醛酸化形成 3-O-葡糖苷酸,被确定为 INPEFA(索格列净) 的主要代谢途径。利福平(一种 UGT 诱导剂)与 400 mg INPEFA(索格列净) 单次联合给药导致 INPEFA(索格列净) 暴露量降低。sotagliflozin暴露量的降低可能会降低疗效。
3、锂
SGLT2 抑制剂与锂剂合并使用可降低血清锂浓度。在INPEFA(索格列净)启动和剂量变化期间,更频繁地监测血清锂浓度。
【成分】
本品主要成分为索格列净。
【贮存方法】
储存于20°C-25°C(68°F-77°F);允许的波动范围为15°C-30°C(59°F-86°F)[见 USP 受控室温]。
【生产厂家】
Lexicon Pharmaceuticals,Inc.
温馨提示:以上资讯由登越药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药业)





