11月1日,南京莱德斯生物技术有限公司(以下简称“莱德斯生物”)宣布,其自主研发、拥有全球知识产权的用于治疗多发性骨髓瘤(MM)的人源化双特异性T细胞结合抗体LBL-034已获得美国食品药品监督管理局(FDA)颁发的孤儿药资格认定(ODD)。
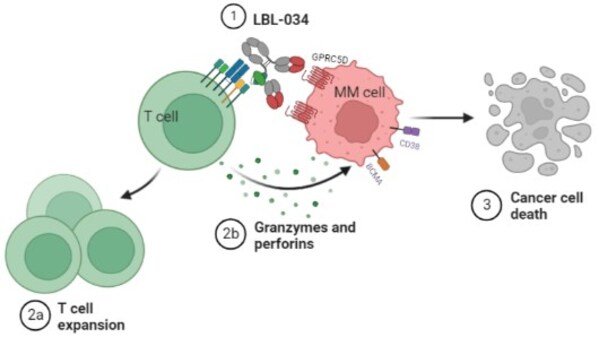
根据 Frost & Sullivan 的数据,LBL-034 是一种采用 Leads Biolabs 专有的 T 细胞衔接抗体技术平台“LeadsBody TM ”设计的新型双特异性抗体,是全球第三个进入临床阶段的 GPRC5D 靶向 CD3 T 细胞衔接剂。通过同时结合 T 细胞上的 CD3 和癌细胞上的肿瘤相关抗原 GPRC5D,LBL-034 使 T 细胞与癌细胞紧密接近,有效激活 T 细胞攻击和杀死目标癌细胞。LBL-034 表现出更高的 GPRC5D 结合亲和力和效力,同时不易诱导 T 细胞耗竭和细胞死亡。广泛的临床前和早期临床研究强烈表明 LBL-034 具有成为同类最佳的潜力。
我们于2023 年 7 月获得 NMPA 和 FDA 的 IND 批准,并于 2023 年 11 月在中国启动 LBL-034 针对复发/难治性多发性骨髓瘤 (RRMM) 患者的 I/II 期首次人体、开放标签、多中心、剂量递增/扩展研究。该研究由 Leads Biolabs 赞助,由北京大学人民医院陆进教授领导,多个临床试验中心参与,该研究的初步数据显示了良好的安全性和强大的疗效。初步数据将于2024 年 12 月 9 日在美国圣地亚哥举行的第 66 届 ASH 年会上公布。
此次孤儿药资格认定的批准,是FDA对Leads Biolabs公司LBL-034在治疗MM方面巨大潜力的认可,将有助于加速LBL-034在全球的临床开发和上市进程。根据美国《孤儿药法案》,孤儿药资格认定是由FDA为鼓励治疗罕见病的药物开发而设立的,它为新药开发提供了一系列的激励措施,包括但不限于:
(1)临床试验费用的税收减免;
(2)FDA对临床研究各个阶段的具体指导;
(3)免除新药注册申请费;
(4)上市后7年的市场独占期。
Leads Biolabs首席医学官Charles Cai博士表示:“很高兴看到我们在新药研发方面取得积极进展,造福MM等罕见病患者。MM仍是一种无法治愈的恶性肿瘤,随着治疗线的增加,肿瘤复发的间隔时间会越来越短,最终演变为RRMM,严重威胁人类的生命健康。开发新的、更有效的治疗方案迫在眉睫。LBL-034采用独特的分子设计,初步临床结果表明其具有良好的抗肿瘤疗效和安全性。我们将加快LBL-034的临床开发,争取早日为全球MM患者带来安全有效的治疗选择。”
Leads Biolabs 创始人、董事长兼首席执行官康小强博士表示:“LBL-034 是 Lead Biolabs 首个获得 FDA 孤儿药资格认定的产品,标志着我们在这条充满挑战但意义非凡的征程上迈出了成功的一步。借此机会,我们将进一步优化管线布局,拓宽在生物制药领域的探索边界,为更多未满足的医疗需求提供创新解决方案。”
关于多发性骨髓瘤
多发性骨髓瘤(MM)是一种由克隆性浆细胞异常增殖引起的浆细胞恶性肿瘤,占全球肿瘤疾病的1%,约占血液系统癌症的10%。SEER注册数据库的最新数据显示,2021年美国约有17.9万名MM患者,符合FDA对罕见病的定义标准。近年来,蛋白酶体抑制剂、免疫调节药物、选择性核输出抑制剂、CD38靶向抗体、双特异性抗体和CAR-T细胞疗法的成功开发,使MM的治疗取得了显著进展。然而,尽管取得了这些成就,但在临床上仍然需要更有效的治疗方案。根据SEER的数据,预计2024年美国将有约35,780名新诊断的MM患者,约占全国报告的所有新癌症病例的1.8%。此外,预计在此期间将有约 12,540 人死于 MM 相关并发症,相当于全国记录的所有癌症死亡人数的约 2.0%。因此,迫切需要关注开发新疗法以应对这一紧迫的医疗挑战。
关于 Leads Biolabs
南京 Leads Biolabs 有限公司是一家临床阶段的生物技术公司,致力于发现、开发和商业化创新疗法,以满足中国和全球肿瘤、自身免疫和其他严重疾病领域尚未得到满足的医疗需求。凭借我们专有的技术平台和强大的药物开发能力,我们精心策划了 12 种创新候选药物的合理设计和差异化产品线,其中 6 种已成功进入临床阶段。Leads Biolabs 致力于提供安全、有效、可及且负担得起的新药,以满足全球患者尚未满足的需求。
参考来源:‘Leads Biolabs Receives Orphan Drug Designation from the US FDA for LBL-034, a Uniquely Designed, Highly Differentiated Anti-GPRC5D/CD3 Bispecific Antibody, for the Treatment of Multiple Myeloma. News provided by Leads Biolabs. November 6, 2024.’
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)





