如果获得批准,PRGN-2012 将成为首个也是唯一一个获得 FDA 批准的治疗 RRP 患者的疗法,RRP 是一种罕见且具有破坏性的慢性疾病,目前的标准治疗方法是重复手术。
美国食品药品监督管理局 (FDA) 已接受该公司针对 PRGN-2012(非专利名称:zopapogene imadenovec †)的生物制品许可申请 (BLA),PRGN-2012 是一种用于治疗成人复发性呼吸道乳头状瘤病 (RRP) 的试验性 AdenoVerse ®基因疗法。FDA 对该 BLA 给予优先审查,并将处方药使用者付费法案 (PDUFA) 目标行动日期设定为2025 年 8 月 27 日。
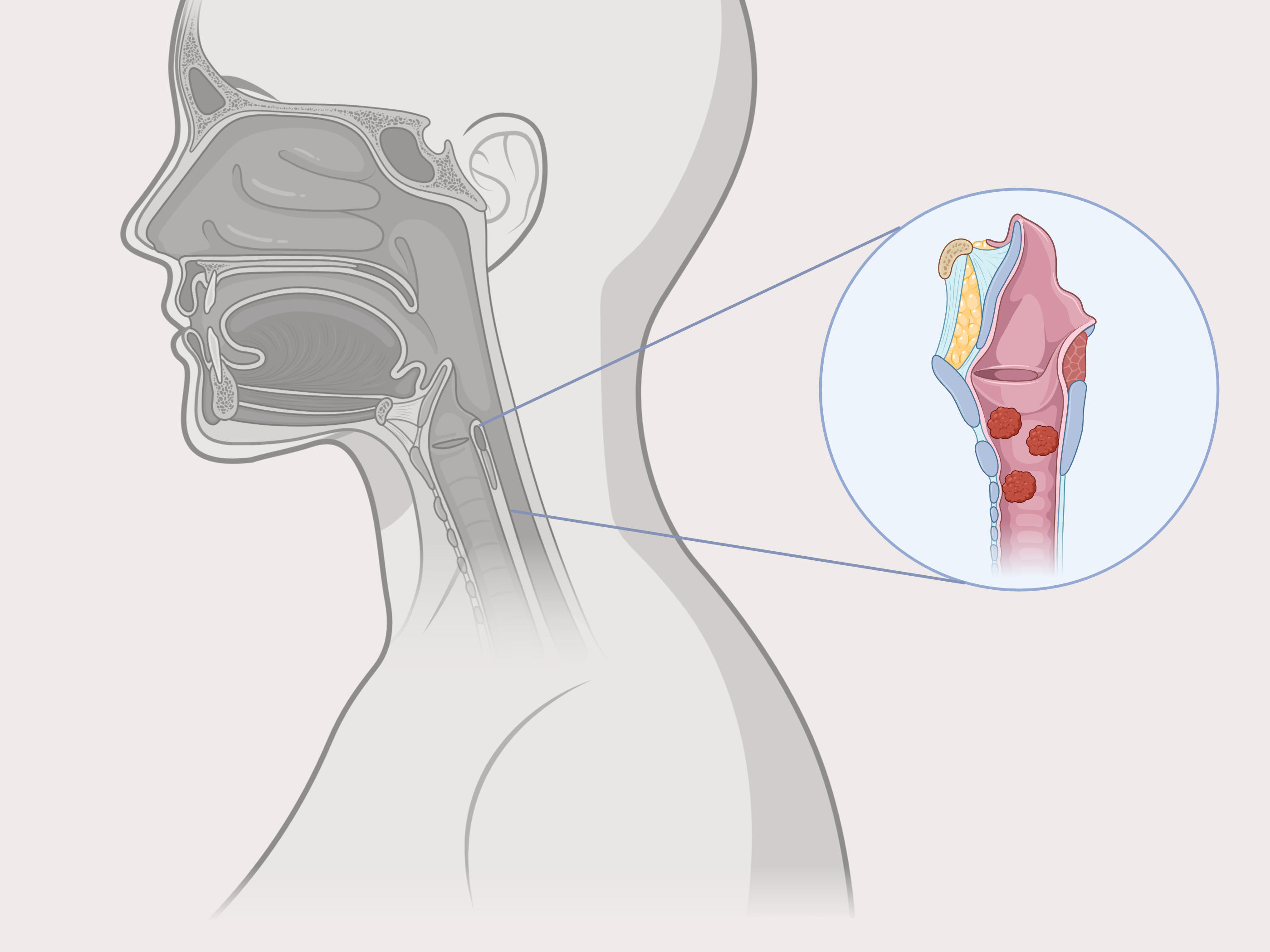
RRP 是一种罕见的肿瘤疾病,由人乳头瘤病毒 (HPV) 6 或 11 感染引起。其特征是整个呼吸消化道都有乳头状瘤,主要影响喉部、气管和肺部。PRGN-2012 是一种基于腺病毒载体的基因疗法,有望诱导针对 HPV 6 或 11 感染细胞的免疫反应。
BLA 得到了关键性 1/2 期试验(ClinicalTrials.gov 标识符:NCT04724980)数据的支持,该试验评估了 PRGN-2012 对 18 岁及以上 RRP 成人患者的安全性、耐受性和有效性,这些患者在研究治疗的前 12 个月内至少接受过 3 次 RRP 相关手术。第 1 期部分是剂量递增试验,以评估 2 种不同剂量(1×10 11和 5×10 11粒子单位),而第 2 期部分评估了推荐剂量的 PRGN-2012 治疗。主要终点是完全缓解率(定义为治疗后 12 个月内不需要手术干预来控制 RRP 的患者比例)。
研究结果显示,在接受 PRGN-2012 推荐剂量 5×10 11粒子单位治疗的患者中,51% (18/35) 的患者获得完全缓解。对于该研究的单独第 1 和第 2 阶段部分,完全缓解率分别为 50% (6/12) 和 52% (12/23)。
此外,与治疗前 12 个月相比,接受 PRGN-2012 治疗后 12 个月内,86% (30/35) 的患者接受 RRP 手术的需要显著减少(P <.0001)。RRP 手术干预次数从中位数 4(治疗前 12 个月)降至 0(治疗后 12 个月)。值得注意的是,接受 PRGN-2012 治疗的患者乳头状瘤生长情况(以 Derkay 评分衡量)和生活质量(以语音障碍指数-10 评估)也显著改善(P 值均<.0001)。
至于安全性,PRGN-2012 耐受性良好,最常见的治疗相关不良事件是注射部位反应、疲劳、发冷和发烧。
Precigen 总裁兼首席执行官 Helen Sabzevari 博士表示:“优先审查资格证明 FDA 认识到 RRP 患者群体存在大量未满足的需求。PRGN-2012 治疗已显示出显著、持久的临床益处。我们期待在未来几个月的 BLA 审查期间与 FDA 合作,并希望向 RRP 患者群体推出首个 FDA 批准的治疗方案。”
参考来源:‘FDA grants Priority Review to Precigen’s BLA for PRGN-2012 for the treatment of adults with recurrent respiratory papillomatosis with PDUFA target action date set for August 27, 2025. News release. Precigen. February 25, 2025.’
香港登越药业温馨提示:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)





