FDA 批准了 avacincaptad pegol 玻璃体内注射液(Izervay;安斯泰来制药)的美国处方信息新版扩展版,用于治疗因年龄相关性黄斑变性 (AMD)引起的地图样萎缩 (GA)。通过此项批准,avacincaptad pegol 的给药时间不受限制,从而鼓励患者和眼科护理提供者灵活地管理 GA。
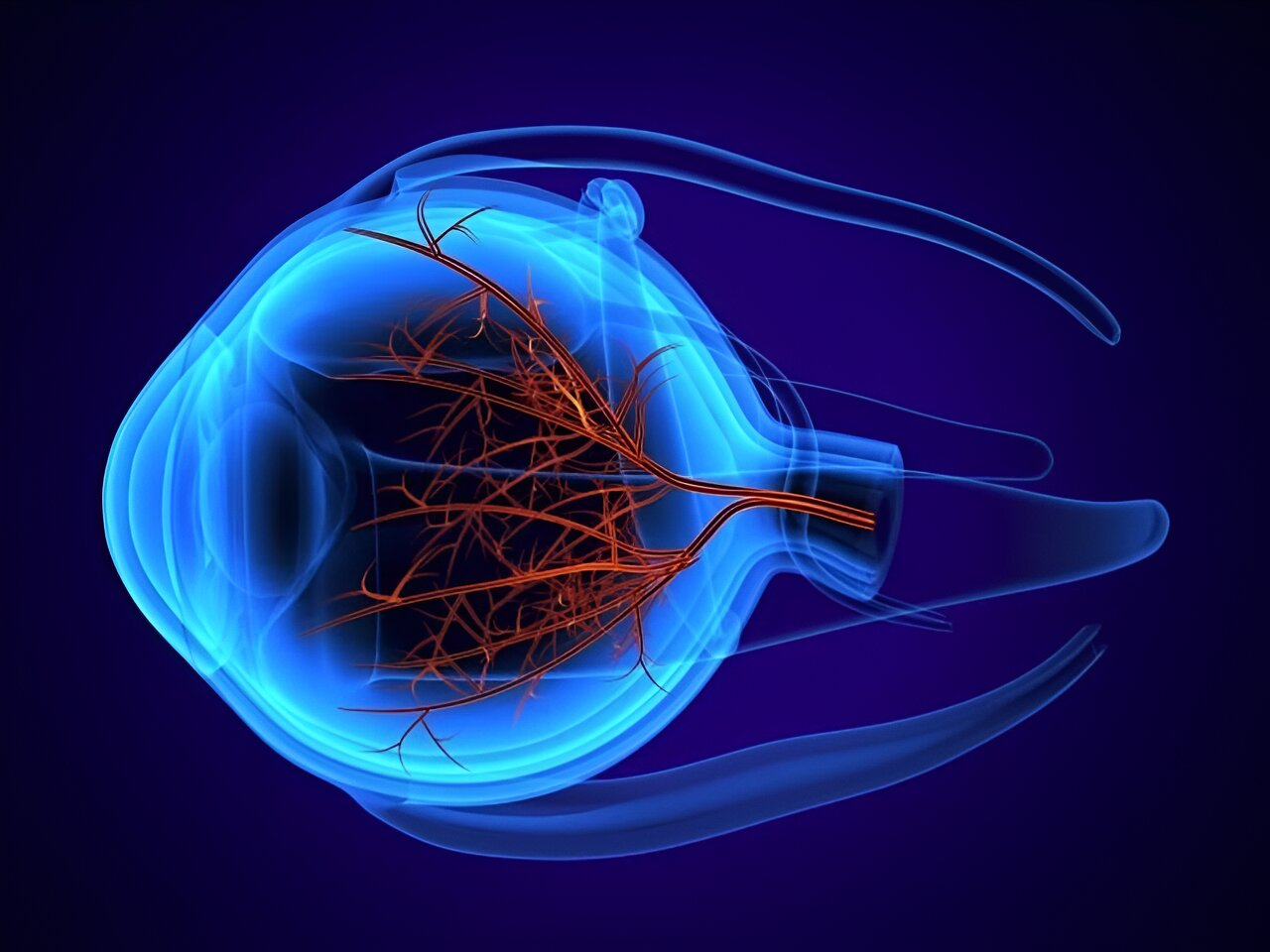
关于地图样萎缩
老年性黄斑变性 (AMD) 是老年人中度和重度中央视力丧失的主要原因,大多数患者的双眼都会受到影响。黄斑是视网膜中央部分的一小块区域,负责中央视力。随着 AMD 的进展,视网膜细胞和黄斑下层血管的损失导致视网膜组织明显变薄和/或萎缩。与 AMD 相关的地图样萎缩会导致这些患者的视力进一步不可逆转地丧失。
关于 GATHER2 临床试验
GATHER2 ( NCT04435366 ) 是一项随机、双盲、假对照、多中心 3 期临床试验,旨在评估玻璃体内注射阿伐他汀 (ACP) 对 448 名患有 AMD 继发性 GA 的患者而言的安全性和有效性。ACP 在 12 个月时达到了其主要目标,在此期间患者被随机分配接受每月一次的 ACP 或假手术。在研究的第 2 年,第 1 年接受 ACP 治疗的患者被重新随机分配接受每月一次的 ACP 给药 (EM,n=96) 或每隔一个月一次的 ACP 给药 (EOM,n=93);第 1 年接受假手术的患者在第 2 年继续接受假手术治疗 (n=203)。IZERVAY 正在一项开放标签扩展研究中继续接受评估。
关于 IZERVAY ™(avacincaptad pegol 玻璃体内注射液)
IZERVAY(avacincaptad pegol 玻璃体内注射液)是一种处方眼部注射剂,用于治疗地图样萎缩 (GA),即干性年龄相关性黄斑变性 (AMD) 的晚期形式。
安斯泰来制药生物制药和眼科开发高级副总裁 Marci English 在新闻稿中表示:“我们很高兴 FDA 决定延长 IZERVAY 的长期使用期限,这进一步巩固了 IZERVAY 自 2023 年上市以来作为数千名 GA 患者值得信赖的选择的地位。”“到目前为止,IZERVAY 仍然是唯一一种在两项关键研究中证明 GA 具有统计学显著减缓作用的 FDA 批准的治疗方法。”
Avacincaptad pegol 玻璃体内注射剂于 2023 年 8 月获得 FDA 批准,并于 2024 年 3 月获得永久 J 代码。据安斯泰来称,截至 2024 年 12 月底,已分发了超过 210,000 瓶 Avacincaptad pegol。该公司还表示,上市后安全报告与临床试验结果保持一致,在 Izervay 上市后没有发现新的或重大的安全信号。
视网膜大学合伙人兼临床试验主任 Veeral S. Sheth 医学博士、工商管理硕士、美国外科医师学会院士、美国放射学会院士 (FASRS) 在一份新闻稿中表示:“对于视网膜专家来说,这是一个令人欣喜的更新,为这种可能导致不可逆视力丧失的慢性进行性疾病的治疗提供了持续的管理选择。”
参考来源:‘U.S. FDA approves expanded label for Astellas' IZERVAY™ (avacincaptad pegol intravitreal solution) for geographic atrophy. PR Newswire. Press release. Published February 12, 2025. Accessed February 13, 2025.’
香港登越药业温馨提示:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)





